| Author | Topic |
|
Posted: 27.02.09 00:19. Post subject: Решение задач
помогите пожалуйста с задачами...вопрос жизни и смерти  заранее спасибо ЗАДАЧА 12 Оптически активный сложный диэфир A состоит только из атомов C, H и O. 2,81 г этого вещества подвергли омылению 30,0 мл 1,00M раствора NaOH. Для того чтобы полностью нейтрализовать непрореагировавший NaOH, потребовалось 6,0 мл 1,00M раствора HCl. Продуктами омыления являются дикарбоновая кислота B, метанол и оптически активный спирт C. В результате реакции спирта C с I2/NaOH образуются желтый осадок и C6H5COONa. Соединение B обесцвечивает бромную воду, а при дегидратации образует циклический ангидрид D. Изобразите структурные формулы веществ A, B, C и D. ЗАДАЧА 13 При дегидрировании 95,0 г гомолога бензола образовался непредельный углеводород (с одной двойной связью), который может присоединить 76,0 г брома. Напишите все возможные структурные формулы исходного углеводорода, если выход первой реакции равен 60%, а второй – 100%. |  |
  
|
|
Replys - 3
[new only]
|
|
|
|
| Администратор

|
Post №: 314
|
|
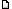
Posted: 27.02.09 14:27. Post subject: ЗАДАЧА 12 ANASTASIA*..
ЗАДАЧА 12 ANASTASIA* пишет: | quote: | | подвергли омылению 30,0 мл 1,00M раствора NaOH. Для того чтобы полностью нейтрализовать непрореагировавший NaOH, потребовалось 6,0 мл 1,00M раствора HCl |
|
Т.е. было 30 ммоль NaOH, из которых лишних было 6 ммоль (прореагировавших с 6 ммоль HCl). Т.е. на омыление пошло 24 ммоль NaOH. Поскольку вещество представляет собой сложный эфир Дикарбоновой кислоты, то на омыление 1 моля её надо 2 моля NaOH, это значит, что если было потрачено 24 ммоль NaOH, то количество исх. диэфира A составляет вдвое меньше, т.е. 12 ммоль = 0,012 моль. Его вес 2,81 г, т.е. молярная масса диэфира А составляет: М(А)=2,81 г/0,012 моль = 234 г/моль ANASTASIA* пишет: | quote: | | ...и оптически активный спирт C. В результате реакции спирта C с I2/NaOH образуются желтый осадок и C6H5COONa. |
|
Реакция с I 2/NaOH - это иодоформная реакция (с образованием желтого осадка - иодоформа CHI 3). Эту реакцию дают метилкетоны R-COCH 3 или соответствующие им спирты R-CH(OH)-CH 3. Поскольку второй компонент - бензоат натрия C6H5COONa, то формула спирта C была C 6H 5-CH(OH)-CH 3. Это - альфа-фенилэтанол, оптически активный спирт. Т.е. исходное вещество А представляет собой сложный эфир какой-то дикарбоновой кислоты с метанолом и альфа-фенилэтанолом. ANASTASIA* пишет: | quote: | | Соединение B обесцвечивает бромную воду, а при дегидратации образует циклический ангидрид D. |
|
Циклический ангидрид образуют, например, фталевая, янтарная, малеиновая кислоты и другие их аналоги. Бромную воду обесцвечивают ненасыщенные соединения, из данного ряда это только малеиновая кислота HOOC-CH=CH-COOH. Т.е. исходное соединение может быть двойным сложным эфиром малеиновой или какой-то аналогичной ей кислоты. Сложный эфир малеиновой кислоты и метилового и альфа-фенилэтилового спиртов выглядит так:  Его молекулярная масса равна 234,25 г/моль, что вполне соответствует тому, что должно быть (см. выше).
|  |
  
|
|
Posted: 28.02.09 00:10. Post subject: спасибо огромное......
спасибо огромное....
еще вот впрос ..решила задачу...мне сказали, что неправильно. Помогите пожалуйста найти ошибку.
ЗАДАЧА 5
1,12 л (н.у.) газа А пропустили через 100 мл раствора, содержащего строго стехиометрическое количество соли Б, при этом выпал окрашенный осадок В (12,7 г) и выделился газ Д. В растворе осталось только вещество Е. Полученный раствор имеет сильную щелочную реакцию. Раствор вещества Е упарили, сухой остаток взвесили. Масса Е 5,6 граммов. Это количество Е снова растворили в воде. На титрование полученного раствора потребовалось 100мл 1 Н серной кислоты. Осадок В отделили и высушили. Он представляет собой темное твердое вещество, возгоняющееся при нагревании. В образует с крахмалом ярко-окрашенные комплексы. Вещества А и Д содержатся в природе, оба они являются сильными окислителями.
?1. Определите все вещества, ответ подтвердите расчетами. Напишите уравнение реакций.
?2. Где встречаются А и Д в природе? Укажите цвета А и Д в газообразном и жидком состояниях.
?3. Человечество до сих пор в значительных количествах получает вещество В из живой природы (т.е. из растений и организмов), предположите откуда добывается В? Какого цвета комплекс В с крахмалом?
?4. Определите молярную концентрацию соли Б в исходном растворе.
мое решение..
Очевидно, В – йод. Его количество n(I2)= 12,7/254 = 0,05 моль
Определим Е. Скорее всего, Е – гидроксид щелочного металла
(растворимы в воде только щелочи и некоторые гидроксиды щелочноземельных металлов). Количество эквивалента серной кислоты
100 • 1/1000 = 0,1 моль. Если Е – гидроксид одновалентного металла, то
М(Е)= 5,6\0,1 = 56. Это гидроксид калия. Если Е – гидроксид двухвалентного металла, то подходящих вариантов нет.
Так как количества I2 и KOH соотносятся как 1:2, скорее всего, это иодид калия. Иод образуется в результате окисления окислителем А. Е не может быть солью кислородных кислот иода, т.к. в таком случае, невозможна реакция окисления газом А, в результате которой выделяется элементарный иод.
Из газообразных окислителей, содержащихся в природе, подходят только озон и кислород. Известна реакция окисления иодида калия озоном с выделением кислорода.
O3 + 2KI + H2O 2KOH + I2 + O2
2KOH + H2SO4 K2SO4 + H2O
2. Кислород и озон встречаются в атмосфере. Это бесцветные газы, жидкий кислород голубо й, а жидкий озон – фиолетовый.
3. Иод добывается из некоторых водорослей. Он образует с крахмалом синий комплекс.
4. Количество иодида калия – 0,1 моль. Объем раствора – 100 мл, значит молярность раствора = 0,1*1000\100 = 1 М.
|  |
  
|
|
|
| Администратор

|
Post №: 315
|
|
Posted: 02.03.09 02:14. Post subject: ЗАДАЧА 5 Посмотрел,..
ЗАДАЧА 5 Посмотрел, вроде всё правильно. Единственно, в реакции 2KOH + H2SO4 = K2SO4 + 2 H2O Вы забыли поставить цифру "2" но это так, мелочи. Также могу сказать, что реакция O3 + 2KI + H2O => 2KOH + I2 + O2 строго говоря, неправильная, т.к. в присутствии сильной щелочи (KOH) свободный иод выделяться (и выпадать в осадок) никак не может, - он будет тут же реагировать с щелочью по реакции: 3 I2 + 6 KOH => 5KI + KIO3 + 3H2O Т.е. реакция пропускания озона через раствор KI (БЕЗ ПОДКИСЛЕНИЯ) будет сводиться к окислению иодида до иодата: KI + 3O3 => KIO3 + 3O2 Но это уже скорее недочёт авторов задачи. Я не знаю, что им не понравилось в Вашем решении. =============== Кстати, задача №13. | quote: | | При дегидрировании 95,0 г гомолога бензола образовался непредельный углеводород (с одной двойной связью), который может присоединить 76,0 г брома. Напишите все возможные структурные формулы исходного углеводорода, если выход первой реакции равен 60%, а второй – 100%. |
|
К двойной связи присоединяются 2 атома брома (молекула Br2). Если в соединении только одна дв. связь, то 1 моль этого соединения присоединит 1 моль Br2 (молярная масса которого 160 г/моль). Т.к. вещество присоединило 76 г Br2, то значит количество вещества было: 76 г : 160 г/моль = 0,475 моль По условию задачи, изначально было 95 г какого-то вещества, которое (при дегидрировании) перешло в соединение с 1 двойной связью с 60% выходом. Если бы в этой реакции его молярная масса не изменялась, то это бы означало, что его стало 57 г. Но во время ДЕгидрирования вещество теряет водород, и его молярная масса уменьшается, значит, масса вещества (полученного в результате дегидрирования) была немного меньше 57 г. Т.к. количество вещества было 0,475 моль, то его молярная масса должна быть немного меньше, чем 57 г / 0,475 моль = 120 г. Т.е. М < 120. Эта молекулярная масса означает, что исходное вещество может содержать не более 1 бензольного кольца (иначе получается перебор). Для того, чтобы в соединении, кот. содержит 1 бензольное кольцо, стало возможным ДЕгидрирование, надо, чтобы в нём был фрагмент -СH2-CH2- , который дегидрируется до -CH=CH- (просто метил, или несколько метилов, связанных с бенз. кольцом, не могут дегидрироваться). Этилбензол C6H5-CH2-CH3 - уже может дегидрироваться до стирола C6H5-CH=CH2, но их молярная масса составляет, соответственно, 106 и 104 (а не 120, как должно быть). А вот если заменить один из водородов на метил (т.е. добавить доп. группу CH2), то получается как раз то, что надо: C9H12 => C9H10 + H2 Молярная масса в этом случает будет 120 у исходного соединения, и 118 у продукта (который потом реагировал с бромом). Подходящие варианты: орто-, мета- и пара-изомеры метил-этилбензола, п-пропилбензон и изопропилбензол (кумол). Они дегидрируются, до соответствующих (орто- мета- и пара-) метил-стиролов. Пропилбензол может дегидрироваться до пропенилбензола (или менее устойчивого аллилбензола); изопропилбензол (кумол) дегидрируется до альфа-метилстирола. Это и будут все возможные формулы. |  |
  
|
|
|


